Pendahuluan
 |
| Air akan mendidih lebih cepat di dataran
tinggi daripada di dataran rendah.Karena tekanan udara luar untuk daerah tinggi memang lebih rendah dibandingkan di daerah dataran rendah, sehingga molekul air lebih mudah terlepas ke udara menjadi uap (mendidih) |
Sifat koligatif larutan adalah sifat larutan yang tidak bergantung pada jenis zat terlarut tetapi hanya bergantung pada konsentrasi pertikel zat terlarutnya. Sifat koligatif larutan terdiri dari dua jenis, yaitu sifat koligatif larutan elektrolit dan sifat koligatif larutan nonelektrolit. Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan.
Sifat Koligatif Larutan meliputi
1. Penurunan tekanan uap
2. Kenaikan titik didih
3. Penurunan titik beku
4. Tekanan osmotik
Pembentukan suatu larutan tidak menimbulkan pengaruh terhadap sifat-sifat kimia zat penyusun larutan tersebut. Air suling (air murni) dan air sumur (air yang mengandung zat terlarut) memperlihatkan reaksi yang sama jika misalnya direaksikan dengan logam natrium. Akan tetapi sifat fisik suatu zat berubah apabila zat itu menjadi komponen larutan
A.Kemolalan dan Fraksi Mol
1.Kemolalan
Kemolalan atau molalitas merupakan pernyataan
konsentrasi larutan yang menyatakan jumlah mol
zat terlarut dalam 1 kg atau 1.000 g zat pelarut.
a.Hubungan Kemolalan dan Kemolaran
Kemolalan (m) dan Kemolaran (M)
Kemolaran dapat dikonversi menjadi kemolalan dengan mengubah lebih dahulu volume larutan
menjadi massa larutan.
b.Hubungan Kemolalan dan Persen Massa
Persen massa adalah jumlah gram zat terlarut
dalam 100 gram massa larutan. Sebanyak 23,4 gram Nacl (Mr = 58,5) dilarutkan dalam
500 gram. Tentukan molalitas larutan NaCl.
Penyelesaian
g NaCl = 23,4 gram; Mr NaCl = 58,5
p air = 500 gram
m = 0,8 m
2. Fraksi Mol
Fraksi mol merupakan pernyataan konsentrasi suatu
larutan yang menyatakan perbandingan jumlah mol
zat terlarut terhadap jumlah mol total komponen
larutan (jumlah mol pelarut + jumlah mol zat terlarut).
Contoh Soal:
Hitung fraksi mol NaCl dan air, jika diketahui 14,6 gram NaCl
dilarutkan dalam 150 gram air. (Mr NaCl = 58,5; H2O = 18)
Penyelesaian:
SIFAT KOLIGATIF LARUTAN
Sifat Koligatif Larutan adalah sifat larutan yang tidak bergantung pada jenis zat terlarut tetapi hanya bergantung pada konsentrasi pertikel zat terlarutnya. Sifat koligatif larutan terdiri dari dua jenis, yaitu sifat koligatif larutan elektrolit dan sifat koligatif larutan nonelektrolit. Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan.
Sifat koligatif larutan adalah sifat larutan yang bergantung pada jumlah
partikel zat terlarut dan bukan pada jenis zat
terlarutnya. Dan sifat ini berlaku pada larutan yang bersifat encer dan zat
terlarut tidak mudah menguap (non volatil).Contohnya : penambahan garam dan etilen glikol ke dalam air akan
menyebabkan penurunan titik beku larutan. Sifat koligatif larutan punya kebalikannya juga yaitu Sifat non Koligatif Larutan,yaitu sifat larutan yang tidak bergantung pada jumlah partikel zat terlarut tapi bergantung pada jenis zat terlarutnya. Contohnya : Penambahan garam dan gula masing masing
akan memberikan rasa asin dan manis.
Karena rasa bergantung pada jenis zat
terlarut dan jumlah partikel zat terlarut, maka
rasa termasuk sifat non koligatif larutan.
Sifat koligatif terdiri dari penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
A. Sifat Koligatif Larutan pada Diagram Fasa
Perhatikan diagram fasa cair berikut.
 |
diagram fasa cair
|
Pada diagram fasa di atas garis putus-putus menunjukkan perilaku anomali air. Garis hijau menandai titik beku dan garis biru titik didih, menunjukkan bagaimana mereka bervariasi dengan tekanan. Kurva pada diagram fasa menunjukkan titik-titik di manaenergi bebas (dan sifat turunan lainnya) menjadi non-analitis" turunannya berkenaandengan (suhu dan tekanan dalam contoh ini) koordinat perubahan terputus-putus(tiba-tiba). 0isalnya, kapasitas panas dari wadah dengan es akan berubah tiba-tiba sebagai wadah dipanaskan melewati titik lebur. 1uang terbuka, di mana energi bebasadalah analitik, sesuai dengan daerah fase tunggal. Daerah satu fasa dipisahkan olehgaris non-analitis, di mana transisi fase terjadi, yang disebut batas fase. Dalamdiagram di sebelah kiri, batas fasa antara air dan gas tidak berlanjut tanpa batas.-ebaliknya, berakhir pada sebuah titik pada diagram fase yang disebut titik kritis. Ini mencerminkan fakta bahwa, pada suhu dan tekanan sangat tinggi, fase cair dan gas menjadi tidak dapat dibedakan, dalam apa yang dikenal sebagai fluida superkritis.Pada air, titik kritisterjadi pada sekitar Pada air, titik kritis ada pada sekitar 647 K dan 22,064 MPa (3.200,1 psi). Keberadaan titik cair-gas kritis mengungkapkan ambiguitas sedikit pelabelan daerah fase tunggal. Ketika terjadi dari cairan ke fase gas, satu biasanya menyeberangi batas fase, namun adalah mungkinuntuk memilih jalan yang tidak pernah melintasi batas dengan pergi ke kanan titik kritis. Dengan demikian, fase cair dan gas dapat berbaur terus menerus ke satu sama lain. Batas fase padat-cair hanya dapat diakhiri dengan titik kritis jika fase padatdan air memiliki grup simetri yang sama. 'atas fase padat-cair dalam diagram fase/at yang paling memiliki kemiringan positif, semakin besar tekanan pada saat tertentu,semakin dekat bersama-sama molekul-molekul saat dibawa ke satu sama lain, yangmeningkatkan efek dari kekuatan antarmolekul substansi itu. Dengan demikian,substansi memerlukan suhu yang lebih tinggi untuk molekul untuk memiliki energiyang cukup untuk keluar pola tetap dari fase padat dan memasuki fase cair. Konsepserupa juga berlaku untuk perubahan fase cair-gas air, karena sifat tertentu, adalahsalah satu dari beberapa pengecualian aturan.
Dan berikut diagram fasa untuk sifat koligatif larutan secara umum.
1.Penurunan Tekanan Uap
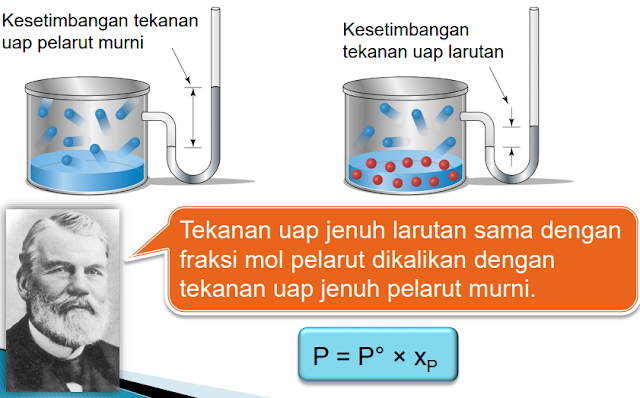
Penurunan tekanan uap adalah fenomena di mana tekanan uap suatu larutan lebih kecil dibandingkan tekanan uap pelarut murninya dengan ukuran kecenderungan molekul-molekul suatu cairan untuk lolos menguap.Tekanan uap adalah tekanan gas yang berada di atas
zat cairnya di dalam tempat tertutup, di
mana gas dan zat cair berada dalam
kesetimbangan dinamis.
( jumlah partikel yang melepaskan diri
dari fase cair ke fase gas sama dengan
fase gas yang terperangkap di
permukaan fase cair ).
Makin besar tekanan uap suatu cairan, makin mudah molekul-molekul cairan itu berubah menjadi uap. Harga tekanan uap akan membesar (cairan makin mudah menguap) apabila suhu dinaikkan. Tekanan uap suatu cairan bergantung pada banyaknya molekul di permukaan yang memiliki cukup energi kinetik untuk lolos dari tarikan molekul-molekul di sekitarnya. Jika ke dalam cairan itu dilarutkan suatu zat, maka kini yang menempati permukaan bukan hanya molekul pelarut, tetapi juga molekul zat terlarut. Karena molekul pelarut di permukaan makin sedikit, maka laju penguapan akan berkurang. Dengan kata lain, tekanan uap cairan itu turun. Makin banyak zat terlarut, makin besar pula penurunan tekanan uap.
Diagram penurunan tekanan uap
Penurunan tekanan dari
P° ke P disebut dengan penurunan tekanan uap,
yang diberi notasi ΔP dapat dirumuskan:
Contoh Soal:
Sebanyak 60 gram urea (Mr = 60) dilarutkan dalam 72 gram
air (Mr = 18). Jika tekanan uap air murni pada 20°C adalah
22,5 mmHg, tentukan tekanan uap larutan dan penurunan
tekanan uap larutan pada suhu itu.
Penyelesaian:
P = P° × Xp(air)
P = 22,5 mmHg × 0,8 = 18 mmHg, ∆P = Po – P = 22,5 – 18 = 4,5 mmHg
2.Penurunan Titik Beku Larutan
Titik beku adalah suhu pada nilai tekanan tertentu, saat
terjadi perubahan wujud zat dari cair menjadi padat.Penurunan tekanan uap akibat zat terlarut yang tidak menguap juga dapat menyebabkan penurunan titik beku larutan. Gejala ini terjadi karena zat terlarut tidak terlarut dalam fasa padat pelarut. Contohnya es murni selalu memisah ketika larutan dalam air membeku. Agar tidak terjadi pemisahan zat terlarut dan pelarut ketika larutan membeku, maka diperlukan suhu lebih rendah lagi untuk mengubah seluruh larutan menjadi fasa padatnya.
Diagram penurunan
titik beku
Penurunan titik beku
larutan diberi notasi Tf.
3.Kenaikan Titik Didih
Titik didih adalah suhu pada saat tekanan uap jenuh
suatu cairan sama dengan tekanan atmosfer di
sekitarnya.
Titik didih zat cair adalah suhu tetap pada saat zat cair mendidih. Pada suhu ini, tekanan uap zat cair sama dengan tekanan udara di sekitarnya. Hal ini menyebabkan terjadinya penguapan di seluruh bagian zat cair. Titik didih zat cair diukur pada tekanan 1 atmosfer. Dari hasil penelitian, ternyata titik didih larutan selalu lebih tinggi dari titik didih pelarut murninya. Hal ini disebabkan adanya partikel - partikel zat terlarut dalam suatu larutan menghalangi peristiwa penguapan partikel - partikel pelarut. Oleh karena itu, penguapan partikel - partikel pelarut membutuhkan energi yang lebih besar. Perbedaan titik didih larutan dengan titik didih pelarut murni di sebut kenaikan titik didih yang dinyatakan dengan (ΔTb).
Diagram kenaikan titik didih
Kenaikan titik didih larutan yang
diberi notasi Tb
Dari rumusan penuruan titik beku larutan
dan kenaikan titik didih larutan dengan
molal yang sama berlaku hubungan :
Massa molekul relatif
(Mr
) zat terlarut Jumlah Zat Terlarut
Tentukan titik beku dan titik didih 0,54 molal (m) glukosa
dalam air. (Kf = 1,86°C.m–1
, Kb= 0,52°C.m–1
)
Penyelesaian:
Titik beku (Tf)
Contoh Soal 2:
Berapa gram glukosa yang harus dilarutkan dalam 100 g air
(Mr = 180) agar larutannya membeku pada –1,5°C (kf =
1,86°C.m–1
).
Penyelesaian:
Tf = T° – Tf
= 0°– ( –1,5°C)
= 1,5°C
4.Tekanan Osmotik Larutan
Tekanan osmotik adalah tekanan yang diberikan kepada larutan sehingga dapat mencegah mengalirnya molekul pelarut memasuki selaput semipermeabel. Misalnya suatu larutan encer dan suatu larutan pekat dipisahkan oleh selaput (membran) yang semipermeabel, yaitu selaput yang dapat ditembus oleh molekul pelarut, tetapi tidak mampu ditembus oleh molekul zat terlarut. Selaput semipermeabel ini dapat berupa gelatin, kertas perkamen, lapisan film selofan, atau membrane sel makhluk hidup. Maka terjadilah peristiwa osmosis, yaitu perpindahan molekul pelarut dari larutan yang memiliki konsentrasi lebih rendah (encer) ke larutan yang konsentrasinya lebih tinggi (pekat) melalui membran semipermeabel.
Peristiwa osmosis menyebabkan naiknya permukaan larutan pekat, sehingga tekanan membesar yang pada gilirannya akan memperlambat laju osmosis. Akhirnya tercapailah suatu tekanan yang mampu menghentikan osmosis atau perpindahan molekul pelarut atau disebut tekanan osmosis. Suatu larutan yang encer memiliki tekanan uap yang lebih besar daripada larutan yang pekat. Artinya, molekul-molekul pelarut dalam larutan encer memiliki kecenderungan lolos (escaping tendency) yang lebih besar.
Tekanan osmotik(π) adalah tekanan yang
diperlukan untuk mempertahankan agar
pelarut tidak berpindah dari larutan encer
ke larutan pekat.Tekan osmotik dirumuskan:R = tetapan gas 0,08206 L atm / mol K
T = Suhu ( derajat Kelvin )
Contoh Soal:
Sebanyak 7,2 g glukosa (Mr = 180) dilarutkan dalam air
sampai volumenya 400 mL. Tentukan tekanan osmotik
larutan pada temperatur 27°C. (R = 0,0821 L.atm/K.mol)
Penyelesaian
T = 27°C = 300 K
Sifat Koligatif Larutan Elektrolit
i = { 1 + (n-1) α }
n = jumlah koefisien kation dan anion
α = derajat ionisasi elektrolit
PENERAPAN SIFAT KOLIGATIF LARUTAN DALAM
KEHIDUPAN SEHARI-HARI
Sifat koligatif larutan terutama pada penurunan titik beku dan tekanan osmosis memiliki banyak
kegunaan dalam kehidupan sehari-hari. Beberapa penerapan penurunan titik beku dapat
mempertahankan kehidupan selama musim dingin. Penerapan tekanan osmosis ditemukan di
alam, dalam bidang kesehatan, dan dalam ilmu biologi.
A. PENERAPAN PENURUNAN TEKANAN UAP
Laut Mati adalah contoh dari terjadinya penurunan tekanan uap pelarut oleh zat
terlarut yang tidak mudah menguap. Air berkadar garam sangat tinggi ini terletak di daerah
gurun yang sangat panas dan kering, serta tidak berhubungan dengan laut bebas, sehingga
konsentrasi zat terlarutnya semakin tinggi. Pada saat berenang di laut mati, kita tidak akan
tenggelam karena konsentrasi zat terlarutnya yang sangat tinggi. Penerapan prinsip yang
sama dengan laut mati dapat kita temui di beberapa tempat wisata di Indonesia yang berupa
kolam apung.
B. PENERAPAN PENURUNAN TITIK BEKU
1. Membuat Campuran Pendingin
Cairan pendingin adalah larutan berair yang memiliki titik beku jauh di bawah 0oC.
Cairan pendingin digunakan pada pabrik es, juga digunakan untuk membuat es putar. Cairan
pendingin dibuat dengan melarutkan berbagai jenis garam ke dalam air.
2. Anti beku pada radiator mobil
Di daerah beriklim dingin, ke dalam air radiator biasanya ditambahkan etilen glikol. Di
daerah beriklim dingin, air radiator mudah membeku. Jika keadaan ini dibiarkan, maka
radiator kendaraan akan cepat rusak. Dengan penambahan etilen glikol dalam air radiator kan
titik beku air dalam radiator menurun, dengan kata lain air tidak mudah membeku.
3. Antibeku dalam Tubuh Hewan
Hewan-hewan yang tinggal di daerah beriklim dingin, seperti beruang kutub,
memanfaatkan prinsip sifat koligatif larutan penurunan titik beku untuk bertahan hidup.
Darah ikan-ikan laut mengandung zat-zat antibeku yang mempu menurunkan titik beku air
hingga 0,8oC. Dengan demikian, ikan laut dapat bertahan di musim dingin yang suhunya
mencapai 1,9oC karena zat antibeku yang dikandungnya dapat mencegah pembentukan kristal
es dalam jaringan dan selnya. Hewan-hewan lain yang tubuhnya mengandung zat antibeku
antara lain serangga , ampibi, dan nematoda.
4. Antibeku untuk Mencairkan Salju
Di daerah yang mempunyai musim salju, setiap hujan salju terjadi, jalanan dipenuhi es
salju. Hal ini tentu saja membuat kendaraan sulit untuk melaju. Untuk mengatasinya, jalanan
bersalju tersebut ditaburi campuran garam NaCl dan CaCl2. Penaburan garam tersebut dapat
mencairkan salju. Semakin banyak garam yang ditaburkan, akan semakin banyak pula salju
yang mencair.
5. Menentukan Massa Molekul Relatif (Mr)
Pengukuran sifat koligatif larutan dapat digunakan untuk menentukan massa molekul
relatif zat terlarut. Hal itu dapat dilakukan karena sifat koligatif bergantung pada konsentrasi
zat terlarut.
C. PENERAPAN TEKANAN OSMOSIS
1. Mengontrol Bentuk Sel
Larutan-larutan yang mempunyai tekanan osmosis yang sama disebut isotonik. Larutan-larutan yang mempunyai tekanan osmosis lebih rendah daripada larutan lain disebut
hipotonik. Sementara itu, larutan-larutan yang mempunyai tekanan osmosis lebih tinggi
daripada larutan lain disebut hipertonik.
Contoh larutan isotonik adalah cairan infus yang dimasukkan ke dalam darah. Cairan
infus harus isotonik dengan cairan intrasel agar tidak terjadi osmosis, baik ke dalam ataupun
ke luar sel darah. Dengan demikian, sel-sel darah tidak mengalami kerusakan.
2. Mesin Cuci Darah
Pasien penderita gagal ginjal harus menjalani terapi cuci darah. Terapi menggunakan
metode dialisis, yaitu proses perpindahan molekul kecil-kecil seperti urea melalui membran
semipermeabel dan masuk ke cairan lain, kemudian dibuang. Membran tak dapat ditembus
oleh molekul besar seperti protein sehingga akan tetap berada di dalam darah.
3. Pengawetan Makanan
Sebelum teknik pendinginan untuk mengawetkan makanan ditemukan, garam dapur
digunakan untuk mengawetkan makanan. Garam dapat membunuh mikroba penyebab
makanan busuk yang berada di permukaan makanan.
4. Membasmi Lintah
Garam dapur dapat membasmi hewan lunak, seperti lintah. Hal ini karena garam yang
ditaburkan pada permukaan tubuh lintah mampu menyerap air yang ada dalam tubuh
sehingga lintah akan kekurangan air dalam tubuhnya.
5. Penyerapan Air oleh Akar Tanaman
Tanaman membutuhkan air dari dalam tanah. Air tersebut diserap oleh tanaman melalui
akar. Tanaman mengandung zat-zat terlarut sehingga konsentrasinya lebih tinggi daripada air
di sekitar tanaman sehingga air dalam tanah dapat diserap oleh tanaman.
6. Desalinasi Air Laut Melalui Osmosis Balik
Osmosis balik adalah perembesan pelarut dari larutan ke pelarut, atau dari larutan yang
lebih pekat ke larutan yang lebih encer. Osmosis balik terjadi jika kepada larutan diberikan
tekanan yang lebih besar dari tekanan osmotiknya.
Osmosis balik digunakan untuk membuat air murni dari air laut. Dengan memberi
tekanan pada permukaan air laut yang lebih besar daripada tekanan osmotiknya, air dipaksa
untuk merembes dari air asin ke dalam air murni melalui selaput yang permeabel untuk air
tetapi tidak untuk ion-ion dalam air laut. Tanpa tekanan yang cukup besar, air secara spontan
akan merembes dari air murni ke dalam air asin. Penggunaan lain dari osmosis balik yaitu
untuk memisahkan zat-zat beracun dalam air limbah sebelum dilepas ke lingkungan bebas.